在生命科学的宏伟蓝图中,精准调控基因表达是解码疾病、开发新药的终极梦想。我们熟知RNA干扰(RNAi)技术,它如同一把“分子剪刀”,可以“沉默”或“关闭”致病基因,并因此获得了诺贝尔奖。但是,如果一个有益的基因(如肿瘤抑制基因)在疾病中被“关闭”了,我们能否有一种技术,像一把“分子钥匙”,重新“激活”或“打开”它呢?
答案是肯定的:这项革命性的技术,就是RNA激活(RNAa)。
2006年,中美瑞康(Ractigen Therapeutics)创始人李龙承博士首次发现了这一现象,开创了一个全新的领域。他证实,一段精心设计的小RNA分子(saRNA)能够精准地激活特定基因的表达,为疾病治疗提供了颠覆性的新思路[2]。
RNAa技术已从一个开创性的科学发现,逐步走向了药物开发的临床前沿。然而,一个核心的科学问题始终是领域内科学家们探寻的“圣杯”:saRNA这把“钥匙”,究竟是如何转动“基因锁”,从而激活基因表达的?
昨日,发表于《核酸研究》(Nucleic Acids Research) 的这项研究在DM1(肌强直性营养不良1型)疾病相关模型与多种细胞系统中,提供了严谨而系统的实验证据,进一步巩固并细化了2016年李龙承实验室提出的RNAa–RITA机制模型[3],为saRNA的工程化设计与转化应用提供了有力支撑与实践范式[1]。
原文来源
标题:Promoter-targeted small RNA duplexes increase MB
标题:Promoter-targeted small RNA duplexes increase MBNL1 transcription and mitigate myotonic dystrophy-associated spliceopathy
DOI: 10.1093/nar/gkaf756期刊:Nucleic Acids Research, 2025, Breakthrough Article

要点速览
研究对象:肌强直性营养不良1型(DM1)关键致病轴——MBNL1功能缺失导致的可变剪接错乱[1]。
核心发现:两条靶向MBNL1最活跃启动子(P2)的saRNA(saMB1_1与saMB1_2)可在多种细胞模型中将MBNL1转录与蛋白水平提升约1.5–3倍,并显著纠正多处DM1剪接生物标志位点[1]。
机制证明:再次验证RNAa为“在靶、转录层面”激活,依赖AGO2、RHA、CTR9等RITA通路组分;引导链为“反义链(AS)”,与目标DNA形成互补;与反义lncRNA(MBNL1-AS1)及启动子隐性转录本无必需关系[1,3]。
工程启示:
- 优先选择“本底转录活跃、易于RNAa”的启动子[1];
- 避免同时使用靶点距离过近的saRNA(存在“空间位阻”)[1];
- 通过“化学修饰限制正义(S)链活性”可降低潜在的miRNA样脱靶而不损失RNAa效率[1]。
转化潜力:为saRNA治疗DM1提供了明确的作用机制与实证数据,也为适应症拓展、化学优化、递送体系与伴随诊断设计等方面提供可执行路线[1,4,5]。
背景:为何是DM1和MBNL1?
DM1是一种经典的RNA毒性疾病,其核心病理并非MBNL基因突变,而是MBNL家族蛋白(尤其MBNL1)被异常CUG扩展重复RNA“绑架”后功能不足,导致全基因组范围的可变剪接程序“返幼态”。既往研究与模型均提示,即使是“适度”的MBNL1水平提升(约1–2倍)也能带来表型改善;因此,如何在生理背景下温和提升内源MBNL1转录,成为更理想的干预路径[1]。
RNA激活(RNAa)正是实现这一目标的理想技术之一:通过精心设计的双链小RNA(saRNA),在细胞核内直接“点亮”目标基因启动子,从而上调转录[2,3]。
研究做了什么[1]?
设计并筛选了靶向MBNL1不同启动子的saRNA,最终锁定两条靶向最活跃启动子P2的优势分子。
在多种细胞模型(DM1患者来源成纤维细胞、肌母细胞,以及HeLa、HEK293T等)中验证上调效果。
在新的疾病模型下,系统性地拆解并验证了saRNA的作用机制,并评估其安全性与潜在脱靶。
关键数据与结论[1]
01
确认作用方式:是“开启转录”,而非“延长寿命”
实验证明,saRNA是直接作用于基因的源头,让它生产出更多新的mRNA,而不是让已有的mRNA活得更久。
02
确认“导航系统”:激活过程严格依赖经典的RITA通路
当把RITA通路中的关键蛋白(如AGO2)“拆除”后,saRNA的激活效果便完全消失,证明其导航系统无误[1,3]。
03
锁定“钥匙和锁孔”:反义链(AS)引导,在位结合DNA
研究证实,是saRNA双链中的反义链这把“钥匙”,在AGO2蛋白的引导下,精准地插入到MBNL1基因启动子DNA这个“锁孔”中,从而开启了整个激活过程。
04
排除干扰,直达靶心:与周边的lncRNA无必需关系
实验排除了一个邻近的长链RNA分子的干扰,证明saRNA是直接作用于DNA靶点,作用机制非常直接、专一。
05
发现“交通规则”:近距离靶点并用会产生“交通堵塞”
一个有趣的发现是,当两条作用于邻近靶点的saRNA同时使用时,效果不升反降。这提示它们在作用时可能会互相“抢位置”,造成“交通堵塞”。
06
达成终极目标:成功逆转分子缺陷
最重要的结果是,当MBNL1蛋白水平被提升后,那些因DM1而出错的分子事件(如INSR基因的错误剪接)得到了显著的纠正,恢复了正常。同时,在实验周期内未观察到明显的细胞毒性,显示了良好的安全潜力。
 图1:saRNA介导的RNA激活(RNAa)[3]及siRNA介导的RNA干扰(RNAi)作用机制示意图
图1:saRNA介导的RNA激活(RNAa)[3]及siRNA介导的RNA干扰(RNAi)作用机制示意图
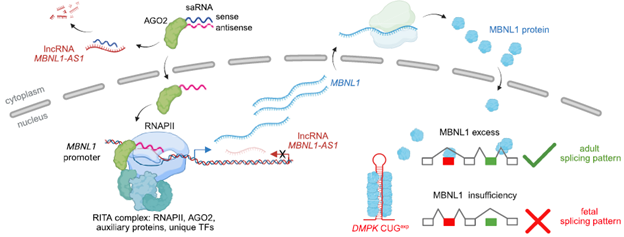
图2:saRNA在DM1细胞模型中的关键药效结果
*图注:saRNA通过AGO2介导的RNAa机制,特异性地激活MBNL1基因的转录,进而纠正在强直性肌营养不良 (DM) 中由MBNL1功能不足引起的异常剪接,为DM的治疗提供了一种新的潜在策略[1]
理论意义:为RNAa“从序列到功能”的通路提供关键验证
该研究独立而系统地验证了RNAa的“核内AGO2导向、RITA复合体赋能、在位转录激活”的通用框架,与李龙承博士团队2006年首次发现RNAa[2]及2016年建立的RNAa机制模型(RITA通路)[3]以来的技术路线与机制模型高度一致。
明确“AS链为引导链、以DNA为主靶、促起始与延伸”的机制要义,进一步巩固了RNAa作为表观转录调控工具的理论地位[1,3]。
通过排除lncRNA/隐性转录本的必需性与识别S链可控的miRNA样效应,为设计去脱靶的saRNA化学修饰与位点策略提供了机制依据[1]。
转化价值:可落地的“工程学原则”
靶点选择: 优先本底活跃、染色质可及性高的启动子;规避同一启动子近距多靶点并用[1]。
化学优化: 以AS链为功能主链进行装载偏置;对S链进行端基修饰/错配以抑制潜在脱靶,同时不损伤RNAa效率[1]。
生物标志: 以“MBNL1蛋白提升+剪接生物标志位点回正”作为药效读出;探索AGO2/RHA/CTR9与特定TF(如MEIS)作为反应预测候选标志[1,3]。
临床验证:saRNA药物正从“可行”迈向“有效”,其临床价值正被迅速验证。率先“探路”的CEBPA-saRNA(MTL-CEBPA)在肝癌中验证了技术的安全性与生物学活性[4]。而紧随其后的p21-saRNA(RAG-01),则在公认的难治领域——BCG无应答膀胱癌中,将临床潜力提升到全新高度:根据EAU 2025年会的报告,其I期初步数据显示,RAG-01在这一难治患者群体中,取得了高达66.7%的完全缓解率(CR)[5]。这一突破性数据不仅是单个药物的成功,更是对整个RNAa技术平台临床价值的强力证明。
挑战与未来方向
目前证据以细胞模型为主,肌母细胞中整体效率低于成纤维细胞,提示递送/摄取与细胞类型特异的染色质状态仍是落地关键[1]。
小鼠模型的跨物种启动子保守性不足限制了体内验证,需通过人源化模型或大型动物研究补强[1]。
S链相关的miRNA样潜在副作用需在更长期与多组织维度下评估,但可通过化学策略显著缓解[1]。
结语
这篇发表于《核酸研究》的关键研究,首次在DM1这一经典RNA疾病模型上,以“从位点筛选—链向性—机制验证—功能读出—工程优化”的闭环路径,系统性地验证了RNAa技术的有效性与精确性。它为领域提供了坚实的证据,证明既有的RNAa-RITA机制模型具有良好的普适性,并为后续的saRNA药物开发提供了宝贵的、可直接应用的工程学原则。随着机制愈发清晰、工程原则逐步固化, saRNA这把“基因钥匙”,有望为更多遗传病、肿瘤等难治性疾病的治疗,开启一扇全新的希望之门 [1–5] 。
参考文献
[1] Musiała-Kierklo N, et al. Promoter-targeted small RNA duplexes increase MBNL1 transcription and mitigate myotonic dystrophy-associated spliceopathy. Nucleic Acids Research. 2025;53(15):gkaf756. doi:10.1093/nar/gkaf756.
[2] Li LC, et al. Small dsRNAs induce transcriptional activation in human cells. Proceedings of the National Academy of Sciences (PNAS). 2006;103(46):17337–17342.
[3] Portnoy V, et al. saRNA-guided Ago2 targets the RITA complex to promoters to stimulate transcription. Cell Research. 2016;26:320–335.
[4] Sarker, D., et al. (2020). A First-in-Human Phase I Study of MTL-CEBPA, a Small Activating RNA Therapeutic Upregulating C/EBP-α, in Patients with Advanced Liver Cancer. Clinical Cancer Research, 26(15), 3936–3946. https://doi.org/10.1158/1078-0432.CCR-20-0414.
[5] First-in-Human Study of RAG-01, a Novel Small Activating RNA Therapeutic, in BCG-Failure NMIBC Patients. UroToday.com. Published March 10, 2025. Accessed August 21, 2025. https://www.urotoday.com/conference-highlights/eau-2025/eau-2025-bladder-cancer/159270-eau-2025-first-in-human-study-of-rag-01-a-novel-small-activating-rna-therapeutic-in-bcg-failure-nmibc-patients.html.
关于中美瑞康
中美瑞康(Ractigen Therapeutics)是一家临床阶段的生物制药公司,致力于开发突破性小核酸药物与疾病治疗方法。中美瑞康是全球少数同时掌握有肝内与肝外递送的小核酸药企之一,开发出了具有独立自主知识产权的SCADTM、LiCOTM及GLORYTM等多个具有国际领先水平的小核酸药物递送平台技术。基于RNA激活技术和自主开发的Smart-TTC saRNA药物开发平台,公司建立了具有高度差异化的小核酸药物管线,适应症涵盖神经退行性疾病、神经肌肉疾病、肿瘤、代谢与血液系统疾病等,为诸多疾病领域中无法成药的靶点、无法治愈的疾病提供创新型治疗方案。详情请访问官网www.ractigen.com。

